 |
Теория ассоциации-индукции Линга
[упрощенный и сокращенный вариант] |
- Теория фиксированных зарядов Линга (ТФЗЛ)
- Теория многослойной организации поляризованной воды в клетке (ТМОПВ)
- Живое состояние покоя
- Состояние покоя как состояние метастабильного равновесия
- Покоящееся живое состояние как низкоэнтропийное состояние
- Чем различаются основные компоненты клетки — физическим состоянием или конформацией?
- Ключевая роль АТФ в поддержании протоплазмы в состоянии покоя
- Почему в структурированных слоях адсорбированной воды ее молекулы связаны между собой более прочно?
- Нативный гемоглобин in vitro
- Гемоглобин, денатурированный NaOH, in vitro
- Сократительный белок миозин in vivo
- Распределение веществ между клеткой и средой
- Проницаемость
- Регуляция объема клетки
- Потенциал покоя
- Электронная плотность на функциональных группах белка — пульт управления жизнедеятельностью
- Смена избирательности ключевых функциональных групп белка — физиологический смысл индуктивного эффекта
- Классификация кардинальных адсорбатов, включая биологически активные вещества
- Как клетка поддерживается в состоянии покоя и что происходит при его изменении — роль кардинальных адсорбатов
- Истинный активный транспорт
- Потенциал действия
- Жизнь и смерть протоплазмы
- Как протоплазма умирает
- Анатомия мертвой протоплазмы
Все началось с ТФЗЛ, после публикации которой в 1952 году Лингу потребовалось еще 10 лет на разработку теории ассоциации-индукции (ТАИ). Чтобы изложить принципиальные положения ТФЗЛ на симпозиуме в Балтиморе в 1952 году, потребовалось меньше часа. Для ее экспериментального обоснования потребовалось более 40 лет. Итоги этой работы будут рассмотрены ниже.
Для удобства изложения лучше разделить ТАИ на две части: ассоциацию и индукцию. Начнем с ассоциации, т.е. связывания.
1. Ассоциация
1.1 Теория фиксированных зарядов Линга (ТФЗЛ)
Самыми значительными по массе составляющими клетки являются вода и белки. Самыми многочисленными по количеству частиц — вода и К+. Ассоциация К+ с белками — главный предмет ТФЗЛ. Ассоциация воды с белками — главный предмет ТМОПВ, о которой речь пойдет сразу после ТФЗЛ.
[Уже сейчас, в самом начале изложения, стоит отметить, что, согласно Ревичу, одним из фундаментальных механизмов, лежащих в основе рака, является ненормальная фиксация калия клетками, либо, наоборот, недостаточность таковой. Не может не поражать тот факт, что две принципиально различных теории оказываются имеющими общую фундаментальную отправную точку — ассоциацию калия с белками.]
Первый вопрос, на который необходимо было дать ответ, формулировался очень просто: почему К+ связывается с фиксированными анионными группами, когда известно, что при той же самой ионной силе К+ не связывается с такими же анионными группами, если они принадлежат веществам в растворе? ТФЗЛ была и остается единственной теорией, которая дала ответ на этот вопрос.
Линг предложил два механизма усиления ассоциации при взаимодействии ионов (в частности K+) с фиксированными центрами адсорбции — 1) электростатический и 2) кинетический.
- Первый механизм заключается в уменьшении энтропии диссоциации в результате усиления электростатического взаимодействия фиксированного заряда с ионом из-за перекрытия электрических полей в среде с высоким содержанием фиксированных зарядов (по сравнению с разбавленным раствором).
- Согласно второму механизму, фиксация центра адсорбции в пространстве снижает энергию столкновений ассоциата с молекулами растворителя и другими ионами и молекулами в растворе, по крайней мере, вдвое, резко увеличивая время жизни ассоциата. Эта закономерность распространяется на адсорбцию как ионов, так и незаряженных молекул. Ко времени публикации ТФЗЛ замечательному эксперименту Керна, показавшему усиление ассоциации противоионов при фиксации одного из зарядов, исполнилось уже 4 года.
ТФЗЛ также впервые предложила:
- Количественный механизм избирательной адсорбции ионов К+ в присутствии Na+.
- Гипотезу внутри- и межмолекулярных солевых связей (между фиксированными анионами и катионами), объясняющую неудачи предыдущих попыток показать избирательную адсорбцию К+ изолированными белками.
- Ответ на вопрос, почему К+ утрачивается клеткой при ее гибели, основанный на роли АТФ как главного кардинального адсорбата.
При помощи только что созданного тогда препарата БНК Линг показал, что субстратом, обеспечивающим избирательное накопление К+ (и вытеснение Na+) в мышечных волокнах, является вся цитоплазма, а не мнимая клеточная мембрана с ее мифическими насосами. Доказательством адсорбированного состояния клеточного К+ и природы центров, связывающих его, являются шесть групп экспериментальных данных, взаимодополняющих друг друга:
- Низкая внутриклеточная электропроводность.
- Резко сниженная подвижность клеточного К+.
- Изменение тонкой структуры полосы поглощения рентгеновского излучения клеточным К+.
- Слишком большие различия коэффициентов активности К+, определяемых внутриклеточным К+-специфичным микроэлектродом в разных клетках, если считать, что этот ион везде свободен.
- Накопление К+ в клетках протекает в соответствии с изотермой Ленгмюра, что означает его достаточно прочное связывание с центрами адсорбции в соотношении 1:1.
- Идентификация большинства К+-адсорбирующих центров как β- и γ-карбоксильных групп, содержащихся соответственно в остатках аспарагиновой и глутаминовой кислот в составе миозина мышечных волокон.
Перейдем теперь к теории и фактам, касающимся ассоциации внутриклеточной воды.
1.2 Теория многослойной организации поляризованной воды в клетке (ТМОПВ)
Согласно ТМОПВ, практически вся вода в клетке объединена в единую динамичную структуру, в отличие от разрозненных в своем большинстве молекул обычной воды. Такая структура является результатом ее взаимодействия с сетью полноразвернутых белковых цепей, пронизывающих все тело клетки. Карбонильные (СО) и иминогруппы (NH), доступные воде, представляют собой чередующиеся отрицательно заряженные N-центры (отрицательные полюса диполей карбонильных групп) и положительно заряженные Р-центры (положительные полюса диполей иминогрупп). Геометрически правильная последовательность этих N- и Р-центров у всех белков, их стерическое соответствие (комплементарность) молекуле воды создают особые условия для ее адсорбции. Сначала образуется первый слой молекул воды, являющихся диполями. Их дипольный момент при взаимодействии с диполями пептидной связи возрастает (т.е. они поляризуются), что является важнейшим следствием такого взаимодействия. Благодаря поляризации возрастает сила водородных связей, а с ними — прочность тех структур, в которых они участвуют. В данном случае возрастает стабильность ассоциатов белок-вода, а затем и вода-вода (в слоях, удаленных от белка). Первый слой воды, сформировавшийся на структурной матрице из N- и Р-центров, обладает правильной структурой и «притягивает» к себе другие молекулы воды, формируя из них следующий упорядоченный слой молекул. В результате такой самосборки могут возникать многослойные прочные структуры из поляризованной воды, свойства которой радикально отличаются от свойств обычной, объемной, воды. В результате «кристаллизации» воды вокруг полипептидных остовов белков вся или почти вся вода клетки становится поляризованной и структурированной.
С позиций ТМОПВ, полноразвернутые белки клетки сходны по своим свойствам с белками, постоянно находящимися в развернутом состоянии (например, с желатином), либо принимающим (частично или полностью) такую конформацию под действием денатурирующих агентов (например, мочевины, гуанидина-HCl, NaOH). И, наоборот, свернутые, глобулярные, белки не имеют ничего общего или мало общего с полноразвернутыми белками. Это предположение позволило выделить два вида моделей, позволяющих воспроизводить те или иные свойства клетки:
- Экстравертные модели, подобные желатину, имитируют полноразвернутые белки клетки, постулируемые ТМОПВ.
- Интровертные модели, к которым относится большинство так называемых нативных (глобулярных) белков, ведут себя совсем иначе.
Еще одно следствие ТМОПВ — подвижность молекул воды в клетках и в экстравертных моделях ограничена, а в интровертных моделях не отличается от подвижности обычной воды. Это предположение подверглось проверке во многих лабораториях. Исследования методом ЯМР времени вращательной корреляции протонов воды, ультравысокочастотные диэлектрические исследования времени переориентации Дебая молекул воды, а также изучение методом квазиупругого рассеяния нейтронов коэффициента вращательной диффузии молекул воды привели к одному и тому же выводу: подвижность молекул воды (и протонов) в клетках и в экстравертных моделях значительно ниже, чем в обычной воде.
Кроме того, более детальное изучение сходства клеток с экстравертными моделями и их отличий от интровертных показало, что к числу общих свойств клеток и моделей в отношении состояния воды в них следует отнести и следующие:
- Осмотическую активность макромолекул в полноразвернутой конформации.
- Понижение температуры замерзания.
- Сходные характеристики поглощения пара при его парциальном давлении, близком к насыщению, но в первую очередь...
- Это способность структурированной воды вытеснять растворенные вещества и из клеток, и из экстравертных моделей.
При помощи количественной теории распределения веществ, созданной в 1993 году, Линг показал, что, казалось бы, незначительное увеличение теплоты парообразования связанной воды всего на 126 кал/моль (на общем фоне в 9717,1 кал/моль для обычной воды — рост на каких-то 1,3%), обусловленное поляризацией молекулы воды при взаимодействии с белком, может количественно объяснить явление, всегда волновавшее умы физиологов — вытеснение сахарозы и Na+ из клеток.
Придерживаясь представления о клетке и о ее фундаментальной структуре — протоплазме — как о фазе, о том, что любая часть клетки обладает теми же фазовыми свойствами, что и клетка в целом, ТМОПВ представила свое понимание физико-химического строения клеточной «мембраны» (в действительности это название не имеет смысла, т.к. эта клеточная структура, в отличие от искусственных мембран, не имеет четкой внутренней границы). В модели Линга непрерывной фазой клеточной мембраны, подобно всей остальной клетке, являются не липиды и не их разнообразные производные, а поляризованная, структурированная вода. Как показывают факты, при таком понимании «мембрана», в сущности, проницаема для любых веществ (хотя проницаемость эта весьма различна), и именно поэтому она не может иметь решающего значения для обеспечения осмотической стабильности клетки и определять ее осмотические свойства так, как это принято считать в мембранной теории из учебников. Осмотическое поведение клетки определяется свойствами протоплазмы как целостной структуры, что подтверждается осмотической стабильностью клеток, полностью лишенных «мембран».
Новое представление о мембране как о границе из поляризованной, ориентированной воды подкреплено рядом взаимодополняющих экспериментов. Скорость диффузии воды через клеточную мембрану такая же, как и через цитоплазму, и на порядки больше скорости диффузии воды через фосфолипидный бислой. Валиномицин, который в концентрации 10-7 М повышает проницаемость для К+ искусственного фосфолипидного бислоя в 1000 раз, не оказывает практически никакого влияния на проницаемость для К+ скелетной мышцы лягушки, яйцеклетки лягушки, гигантского аксона кальмара, лимфоцитов человека и внутренней мембраны митохондрий печени мыши.
Наконец, проницаемость ацетилцеллюлозной мембраны для воды и шести неэлектролитов определяется теми же физическими факторами, что и проницаемость кожи лягушки для тех же веществ и при тех же температурах (0°, 4° или 25 °С). В ацетилцеллюлозной мембране, практически непроницаемой для сахарозы, подобно коже лягушки, имеются поры, заполненные поляризованной и ориентированной водой. Их средний диаметр (без воды) в 5 раз превышает размер молекулы сахарозы и, тем не менее, такая мембрана остается для нее полностью непроницаемой. Этот факт опровергает представление о том, что ее непроницаемость для сахарозы обусловлена еще одним фантастическим механизмом — механизмом сита. Поры ацетилцеллюлозной или клеточной мембраны непроницаемы не потому, что они слишком малы в сравнении с размером иона или молекулы, а потому, что они заполнены связанной, структурированной водой, и чем лучше вещество растворяется в такой воде (правило размера Линга), тем выше для него проницаемость «мембраны».
Стоит отметить еще два важных достижения ТМОПВ.
- Во-первых, ТМОПВ впервые объяснила, чем желатин принципиально отличается от большинства нативных (глобулярных) белков — своей открытой для воды структурой, полноразвернутой конформацией, благодаря которой он способен связывать воду. ТМОПВ также объяснила, что такое коллоид — макромолекулы или агрегаты частиц, связывающие воду или другой растворитель в многослойные поляризованные структуры, и что такое коацерват — автономная кооперативная фаза, содержащая параллельно ориентированные коллоиды.
- Во-вторых, Рэймонд Дамадьян, задавшийся целью проверить методом ядерно-магнитно-резонансной спектроскопии предсказанное ТМОПВ связанное состояние клеточной воды, изобрел МРТ (магнитно-резонансную томографию).
|
Терапевтическая польза, которую мы извлекаем из п.п. 1.1-1.2 — становятся понятны:
- широчайший спектр терапевтических эффектов от внутривенных инъекций соляной кислоты
- некоторая польза от уринотерапии, считающейся извращением
- абсолютная необходимость едкого натра в растворах Самохоцкого.
|
2. Индукция
Индуктивная часть ТАИ призвана объяснить физическую природу живого состояния:
- как оно поддерживается и регулируется,
- в чем фундаментальная основа физиологической активности и
- каковы принципиальные изменения, сопровождающие гибель клетки.
2.1 Живое состояние покоя
Согласно ТАИ, отправным пунктом всех процессов жизнедеятельности является протоплазма в состоянии покоя. В этом состоянии все три основных компонента клетки (белки, вода и ионы К+) ассоциированы между собой и находятся в состоянии термодинамического равновесия со средой.
2.2 Состояние покоя как состояние метастабильного равновесия
Идея равновесия в ТАИ резко противоречит представлению о жизни как об установившемся режиме обмена веществ. Представление о жизни, описанное в учебниках, подобно пламени свечи, под чьей спокойной и неизменной формой скрываются непрерывные химические реакции. В учебниках жизнь рассматривается как внешнее выражение непрерывных биохимических реакций, в ходе которых производится АТФ, идущая непрерывным потоком на перекачивание Na+ и другую бессмысленную работу — эдакая белка в колесе. Но, как уже говорилось, теория мембранных насосов полностью изжила себя — к ней полезно время от времени возвращаться лишь для осознания всей ее нелепости в свете истинного положения дел.
Как и любые химические реакции, биохимические реакции также прекращаются, если температура снижается до десятков и сотен градусов ниже нуля (например, при температуре жидкого азота), не говоря уже о температурах, близких к абсолютному нулю. Если бы жизнь в самом деле поддерживалась непрерывными химическими реакциями, то при такой температуре она неминуемо угасла бы навсегда, как пламя свечи. Однако состояние термодинамического равновесия, на котором настаивает ТАИ, вовсе не обязательно должно разрушаться при сверхнизких температурах. Широко известно, что не только клетки, но и целые эмбрионы (в том числе человека) можно сохранять живыми, хотя и «спящими», в жидком азоте. И в любой момент можно восстановить нормальную жизнедеятельность замороженной клетки или ткани. Возможность криоконсервации клеток доказывает, что ее фундаментальная структура — протоплазма — существует в состоянии (не энергозатратного) метастабильного равновесия.
2.3 Покоящееся живое состояние как низкоэнтропийное состояние
В ТАИ клетка и протоплазма обладают низкой энтропией, в первую очередь, благодаря адсорбированному состоянию клеточной воды, клеточного К+, конгруэнтных анионов, АТФ и т. д., что было неоднократно подтверждено экспериментально. ТАИ также предсказывает, что клетка и протоплазма склонны спонтанно утрачивать способность удерживать воду и К+ в связанном состоянии (что ведет к увеличению подвижности внутриклеточной воды и ионов К+) уже при умеренных подъемах температуры. Это подтверждается тем фактом, что мышцы лягушки погибают при нагревании всего лишь до 41 °С.
Термодинамика говорит нам, что изменение свободной энергии (ΔF) в ходе химической реакции связано с изменением энтальпии или теплосодержания (ΔН), а также с изменением энтропии (ΔS) уравнением: ΔF = ΔН - T*ΔS. Спонтанность перехода мышцы лягушки из нормального живого состояния покоя в мертвое состояние при 41 °С указывает на то, что ΔF этой реакции отрицательно (то есть свободная энергия системы уменьшается). Тот факт, что этот переход запускается столь незначительным повышением температуры, говорит о том, что изменение энтропии (ΔS) при спонтанном переходе должно быть положительным и настолько большим, что T*ΔS превышает теплопоглощение — положительное изменение энтальпии (ΔН). В сумме изменение свободной энергии (ΔF) становится отрицательным, а реакция — термодинамически выгодной, то есть проходит самопроизвольно. Этот простой анализ показывает, что энтропия живых клеток ниже, чем мертвых, как и утверждает ТАИ.
|
Терапевтическая польза, которую мы извлекаем из п.п. 2.1-2.3:
- Покой, сон, медитация и прочие состояния с низкими энергозатратами имеют к сохранению и поддержанию здоровья намного большее отношение, чем физкультура, спорт и прочая бурная жизнедеятельность.
- Холодовые процедуры с целью достижения максимальной толерантности к низким температурам — один из ключей к долголетию. Но, естественно, не единственный. При этом адаптация к холоду невозможна без соблюдения вполне определенных правил питания.
|
2.4 Чем различаются основные компоненты клетки — физическим состоянием или конформацией?
Три главных компонента протоплазмы и клетки — это вода, белки и ионы К+. Адсорбированное состояние К+ и воды в клетках уже установлено, и еще одно, термодинамическое обоснование этого утверждения, приведено выше. Но особого внимания со стороны теории требует конформация внутриклеточных белков. Пытаться обнаружить действительно нативную (как ее понимает ТАИ) конформацию белков в клетке в состоянии покоя — это все равно, что пытаться выяснить, жива или мертва кошка внутри черного ящика, если при каждом его открывании впрыскивать в него предварительно порцию сильнейшего яда, мгновенно убивающего животное. Это нужно понимать так, что мы никогда не сможем установить истинную конформацию белков внутри покоящейся клетки, если всякий раз будем измельчать ее, экстрагировать белок весьма нефизиологичными растворами и проходить все остальные жесткие этапы, которые обычно включает выделение так называемых нативных белков. Необходим неинвазивный подход, которого, естественно, нет и не предвидится.
2.4.1 Выяснение конформации гемоглобина по распределению ионов К+ и Na+ между эритроцитами и средой
Эритроциты, как и большинство клеток, избирательно накапливают К+ и частично вытесняют Na+. Гемоглобин составляет 97% внутриклеточных белков эритроцитов. Исходя из установленного адсорбированного состояния К+ и воды в клетках, мы вправе ожидать, что гемоглобин играет важную роль в адсорбции К+ и вытеснении Na+. Однако так называемый нативный гемоглобин, будучи растворенным в воде в той же концентрации, что и в нормальных эритроцитах (36%), адсорбирует лишь малую часть ионов К+ или Na+, либо вовсе их не связывает. Кроме того, вода в 36% растворе нативного гемоглобина не вытесняет Na+.
ТАИ утверждает, что гемоглобин в эритроцитах отличается по свойствам от выделенного «нативного» гемоглобина, так как имеет в покоящейся клетке совершенно иную конформацию. Это подтверждают две группы данных.
- Действительно, обработка раствором NaOH в концентрации 0,4 М освобождает не только все β- и γ-карбоксильные группы, делая возможной стехиометрическую избирательную адсорбцию ими Na+ или К+, но и NHCO-группы полипептидного остова, позволяя им связывать, поляризовать и ориентировать окружающую воду, превращая ее в плохой растворитель для сахарозы и Na+. Как видно из этих опытов, гемоглобин способен адсорбировать К+ и снижать растворимость Na+ в воде, и он делает это тогда, когда возникают соответствующие условия. Каковы же эти условия? Заглянем для этого в живой эритроцит.
- Если поместить свежие эритроциты в гипотонический раствор и подвергнуть их гемолизу, они утрачивают полностью или частично гемоглобин, ионы К+ и способность частично вытеснять Na+. Если к полученной таким образом взвеси теней эритроцитов добавить сахарозу, восстановив этим изотоничность среды, тени замкнутся, а их последующая инкубация при 37 °С вновь приведет к накоплению К+ и вытеснению Na+ — но это возможно лишь при условии, что в растворе до образования замкнутых теней будет присутствовать необходимое количество АТФ, а в самих тенях останется достаточное количество гемоглобина и некоторое количество прочно связанного, устойчивого к гемолизу вспомогательного белка X.
[В этой связи уместно будет привести цитату из диссертации Самохоцкого, глава 7: «Экспериментальной проверке надлежало дать ответ на следующие вопросы: вызывают ли данные вещества изменение биологических свойств крови, т.е. каково их влияние на свертываемость крови, гемолиз эритроцитов, оседание их и т.д. и...
Исследование этих моментов показало следующее: данные составы значительно задерживают процесс свертывания крови. Гемолиз эритроцитов почти отсутствует при разведении 1:1... Реакция оседания эритроцитов при смешении с этими составами была значительно замедлена».]
Согласно экспериментальным данным, равновесное содержание К+ в тенях, как и степень вытеснения Na+ из них, количественно связано с содержанием в них остаточного белка (в основном гемоглобина) — чем больше белка, тем больше ионов К+ в тенях, тем сильнее вытеснение Na+ из них. Замкнутые «белые» тени, полностью лишенные гемоглобина, не накапливают К+ и не вытесняют Na+. Более того, гемоглобин, необходимый для накопления в тенях К+ и вытеснения Na+, вовсе не обязан быть «родным» гемоглобином эритроцитов. Его можно заменить на чужеродный гемоглобин так, чтобы при закрытии теней после гемолиза он оказался внутри восстановленных клеток-теней.
В совокупности представленные данные показывают, что конформация гемоглобина в эритроцитах отличается от конформации выделенного нативного гемоглобина тем, что NHCO-группы его полипептидного остова, а также β- и γ-карбоксильные группы свободны от водородных и солевых связей и потому способны связывать воду и К+. Кроме того, ясно, что гемоглобин, присутствующий изначально или введенный извне в тело эритроцита, принимает эту конформацию под влиянием АТФ и ее помощников — белка X, а также конгруэнтных анионов (Сl-).
2.4.2 Определение конформационного состояния миозина в мышечных волокнах лягушки по распределению неэлектролитов между клеткой и средой
Желатин, полиэтиленоксид (ПЭО), денатурированный NaOH гемоглобин, и другие экстравертные модели имеют в растворах полноразвернутую конформацию. Благодаря этому они способны связывать значительное количество воды и вытеснять неэлектролиты в объем, заполненный свободной водой, и этот эффект тем значительнее, чем больше размер молекул растворенного вещества. График зависимости величин q неэлектролитов от логарифма их молекулярной массы (или молекулярного объема) представляет собой S-образную кривую. В случае растворов нативных (глобулярных) белков величина q почти не меняется, оставаясь около значения, близкого к 1 при самых разных размерах молекул неэлектролитов (вплоть до молекулярного объема около 500 мл/моль). Подобно неэлектролитам в растворах экстравертных моделей — и в противоположность растворам «нативного» гемоглобина — график зависимости величин q, полученный для 21 неэлектролита в мышечных волокнах лягушки, от их молекулярного объема представляет собой S-образную кривую. На основании этого сравнения можно сделать однозначный вывод, что основные мышечные белки — миозин и актин — имеют в покоящемся мышечном волокне лягушки конформацию, близкую к полноразвернутой.
Этот вывод подкрепляется и другими чертами сходства свойств клеточной воды и воды в растворах экстравертных макромолекул, которыми, однако, не обладает вода растворов интровертных полимеров.
2.4.3 Выяснение конформации миозина и актина в мышечных волокнах лягушки по поглощению водяного пара
Мышца лягушки примерно на 80% состоит из воды, и на 20% — из белков. При таком соотношении 1 г белков мышечных волокон в среднем должен поглощать, согласно ТМОПВ, 4 г воды. При помощи нового метода нулевой точки, Линг и Ху изучили поглощение пара интровертными белками и экстравертными полимерами — желатином, полиэтиленоксидом (ПЭО), поливинилпирролидоном (ПВП) и поливинилметиловым эфиром (ПВМЭ), — в труднодостижимых условиях, когда относительное давление пара близко к насыщению.
Результаты показали, что лишь экстравертные модели (макромолекулы в полноразвернутой конформации) при этом (физиологическом) давлении пара могут поглощать почти столько же воды, сколько и мышцы лягушки. В то же время, все исследованные глобулярные белки поглощают лишь от ¼ до ½ того количества воды, которое могут поглощать мышечные волокна лягушки. Эти данные еще раз показывают, что если не весь миозин и актин, то хотя бы их большая часть должна находиться в полноразвернутом состоянии, которое одно только способно поглотить столько воды, сколько поглощается интактными мышечными волокнами.
Кстати, концентрация свободных веществ в клетке (таких, как Na+ и Сl-) слишком низка, чтобы значимо влиять на поглощение воды через механизм осмоса. Более распространенные в клетке вещества — такие, как К+, АТФ и креатинфосфат — адсорбированы и вследствие этого осмотически неактивны или почти неактивны.
|
Терапевтическая польза, которую мы извлекаем из п. 2.4 — становятся понятны:
- фундаментальная роль хромовых солей в растворах Самохоцкого в поддержании жизнеспособности умирающих клеток
- роль растворов Самохоцкого в предотвращении гемолиза
- принципы терапии шоковых, травматических состояний.
|
2.5 Ключевая роль АТФ в поддержании протоплазмы в состоянии покоя
Для того чтобы сыграть полный драматизма спектакль под названием «жизнь», каждый из множества кардинальных адсорбатов должен выполнить отведенную ему роль. Но ни один из них не может играть свою роль без АТФ. Адсорбция именно АТФ соответствующими кардинальными центрами совершенно необходима для формирования и поддержания протоплазмы в основном состоянии — состоянии покоя, т.е. отправной точке для совершения всех видов биологической работы. Это фундаментальное положение иллюстрирует рисунок
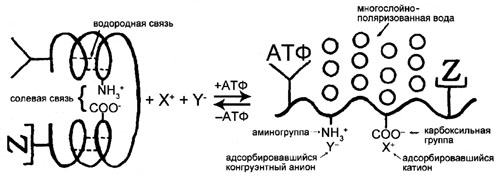
на котором схематично показано, как АТФ поддерживает элементарную живую машину в живом состоянии, то есть возвращает ее в состояние покоя.
Два отличительных признака покоящегося состояния:
- избирательная адсорбция К+ в присутствии Na+ и
- связанное состояние воды, из которой в силу ее структурированности частично вытесняются Na+, сахароза и другие вещества, для которых она оказывается плохим растворителем.
ТАИ предсказывает прямую пропорциональную зависимость между уровнем АТФ в клетке и равновесным содержанием в ней К+. Аналогично, должна существовать и обратная пропорциональная зависимость «АТФ — Na+» и «АТФ — сахароза». Экспериментальные данные подтверждают все эти предположения.
|
Терапевтическая польза, которую мы извлекаем из п. 2.5 — становится понятна принципиальная важность стимуляции выработки АТФ клетками, чего мы и добиваемся многими из наших препаратов.
|
2.6 Почему в структурированных слоях адсорбированной воды ее молекулы связаны между собой более прочно?
Поясним природу этой дополнительной энергии с помощью простых моделей.
- Ориентация диполей воды. Каждая молекула воды может рассматриваться как электрический диполь, хотя у нее и три полюса — один отрицательный и два положительных. Если два таких диполя расположены параллельно — одноименными полюсами в одну сторону — они будут отталкиваться. Если же они ориентированы антипараллельно, то будут притягиваться друг к другу. Основной причиной появления дополнительной энергии взаимодействия между собой связанных молекул воды в клетке является именно такая антипараллельная ориентация соседних молекул в многослойных водных структурах, в результате которой дипольный момент молекулы возрастает и она поляризуется.
- Раствор желатина. В обычной воде тепловое движение ее молекул мешает им надолго сохранять антипараллельную ориентацию. Ситуация меняется при добавлении в воду желатина. Не меньше половины полипептидного остова молекулы этого белка находится в полноразвернутой конформации, их СО- и NH-группы фиксированы в пространстве (скорость теплового движения молекулы желатина в составе геля практически равна нулю), и в силу принципа усиления ассоциации при фиксации центров связывания молекулы воды адсорбируются полипептидным остовом на более продолжительное время, чем время взаимодействия молекул воды в растворе без желатина. Тесное взаимодействие молекул воды с указанными диполями пептидной связи не только мгновенно влечет за собой их поляризацию и антипараллельную ориентацию в первом слое воды, но и передает эти изменения на соседние слои, формируя их один за другим. Таким образом, СО- и NH-группы полноразвернутых цепей желатина играют роль «центров кристаллизации» в процессе упорядочивания клеточной воды и индуцируют увеличение дипольного момента молекул воды, что приводит к усилению водородных связей между адсорбированными молекулами воды и к увеличению прочности всей водной структуры вокруг молекулы желатина. Обратите внимание, что и до, и после введения желатина система представляет собой стабильную динамичную структуру в состоянии термодинамического равновесия. Вода, взаимодействуя с желатином, переходит из высокоэнтропийного низкоэнергетического состояния в низкоэнтропийное высокоэнергетическое состояние многослойно организованной поляризованно-ориентированной воды.
- Живая клетка. Белки клетки, например, миозин и актин в мышечных волокнах или гемоглобин в эритроцитах, играют, подобно желатину, роль «центров кристаллизации» в создании многослойной динамичной структуры антипараллельно ориентированных молекул воды. При этом и в клетке связанная вода поляризуется, заметно стабилизируя организованную водную структуру вокруг белка.
3. Протоплазма — глубоко интегрированная система молекулярных взаимодействий
Содержание воды в клетке составляет около 44 М; β- и γ-карбоксильных групп, адсорбирующих К+, — около 100 мМ; АТФ — 5 мМ. Поскольку вся вода и К+ в клетке находятся под контролем АТФ, на каждую молекулу связанной АТФ приходится в среднем 20 связанных ионов К+ и 8800 связанных молекул воды.
Возникает вопрос, как одной молекуле АТФ удается контролировать связывание почти 9000 молекул воды и ионов?
Это возможно благодаря а) линейному и б) объемному распространению индуктивного эффекта
- вдоль полипептидной цепи
- через короткие боковые радикалы, в том числе с β- и γ-карбоксильными группами и
- через слои поляризованной, ориентированной воды на весь объем клетки.
Сначала остановимся на линейном распространении.
3.1 Нативный гемоглобин in vitro
Весьма точные данные Листера по оксигенированию/деоксигенированию гемоглобина человека строго подчиняются изотерме адсорбции Янга-Линга. В уравнении изотермы фигурирует единственная константа внутреннего равновесия (K00i→j), равная 0,1 мм рт. ст.-1, и единственный параметр, характеризующий энергию взаимодействия ближайших центров (-γ/2), равный +0,67 ккал/моль. Тот факт, что для описания связывания гемоглобина с кислородом (или обратного процесса) требуется только лишь один параметр -γ/2, прямо указывает на то, что группы гема ведут себя как единое целое, хотя их разделяют длинные полипептидные цепи. Обратите внимание на то, что этот вывод сделан не из общих соображений вроде «конформационных изменений» и «аллостерических влияний», а на основе индуктивного эффекта — физического явления, описанного языком математической физики.
3.2 Гемоглобин, денатурированный NaOH, in vitro
Взглянув на аминокислотную последовательность цепей гемоглобина, нетрудно заметить, что расстояние между ближайшими β- и γ-карбоксильными группами в этом белке сильно варьирует: от 1 аминокислотного остатка (например, α74асп-α75асп) до 23 (β50асп-β73асп). Несмотря на это, для количественного описания адсорбции Na+ каждой β- и γ-карбоксильной группой молекулы денатурированного гемоглобина требуется наличие в соответствующем уравнении только лишь одного параметра -γ/2, равного в данном случае +0,824 ккал/моль. Если бы таких параметров требовалось два и больше, это бы означало, что в молекуле гемоглобина существует две или больше автономных областей.
3.3 Сократительный белок миозин in vivo
В скелетных мышцах лягушки 80% всех β- и γ-карбоксильных групп, способных связывать К+, принадлежат миозину. Размеры этого белка еще больше, чем гемоглобина, и соседние β- и γ-карбоксильные группы также находятся на разных расстояниях друг от друга. Однако кривая поглощения К+ (и Na+) мышечным волокном лягушки также строго подчиняется уравнению Янга-Линга, которое и в этом случае содержит только лишь один параметр -γ/2, равный +0,62 ккал/моль.
Самого пристального внимания заслуживает тот факт, что
- и поглощение кислорода центрами гема нативного гемоглобина
- и адсорбция Na+ β- и γ-карбоксильными группами денатурированного гемоглобина
- и адсорбция К+ β- и γ-карбоксильными группами мышечных волокон лягушки
характеризуются не множеством значений, а единственным (в каждом случае) значением параметра -γ/2. Физический смысл этой закономерности в том, что во всех случаях распространение индуктивного эффекта вдоль полипептидной цепи, обеспечивающего интеграцию функциональных групп белков как в масштабе одной молекулы, так и в масштабе клетки, безразлично к расстоянию между этими группами.
Независимость параметра -γ/2 от расстояния между соседними центрами связывания полностью согласуется с описанной Лингом теоретической моделью незатухающей дистанционной передачи индуктивного эффекта, включающей серию ближних передач. Эта модель действует по принципу домино: сила удара одной костяшки по другой не зависит от расстояния до того места, где цепная реакция началась. Тема о клетке как интегрированной системе будет продолжена ниже.
Теперь перейдем к объемному распространению индуктивного эффекта через связанную воду. Физическим явлением, лежащим в основе такой передачи, является увеличение дипольного момента молекул воды при их взаимодействии с функциональными группами (диполями) пептидной связи и, далее, с соседними молекулами воды в составе водной оболочки, формирующейся вокруг белка. В идеальных условиях — при сильно полярной NP-поверхности (полипептидный остов белка) и при температуре абсолютного нуля — дополнительная энергия взаимодействия соседних молекул воды (из-за возросшего дипольного момента) в динамичной многослойной структуре поляризованной и ориентированной воды постоянна и не уменьшается по мере удаления от N- и Р-центров. Конечно, в реальности температура окружающей среды далека от абсолютного нуля, и NP-поверхности не идеальны. Из-за этого дальность действия индуктивного эффекта ограничена. Но рассмотренные в книге Линга данные свидетельствуют о том, что даже в реальных условиях его дальность весьма велика.
4. Объяснение четырех фундаментальных физиологических явлений
В годы своего расцвета мембранная теория была способна, казалось, объяснить все 4 фундаментальных свойства клетки одним простым, но нелепым предположением: клетка — это разбавленный раствор электролитов и других осмолитов, заключенный в мембрану толщиной около 100 Å, а белковый матрикс клетки, как неотъемлемый элемент конструкции, можно в расчет не принимать. И на таком вот фундаменте была выстроена (и до сих пор стоит и шатается от малейшего ветерка как глиняный колосс) вся наука о клетке. После ее фактического краха настал черед ТАИ дать объяснение тех же самых физиологических явлений при помощи почти столь же простого предположения: клетка — это протоплазма, интегрированная структура клетки, поддерживаемая в состоянии покоя ключевым фактором — АТФ, — и еще рядом вспомогательных факторов.
К сожалению, объяснение двух явлений (из четырех) с позиций ТАИ требует серьезной работы с формулами и графиками. Вываливать все это на неподготовленного читателя негуманно — данный текст и без того весьма сложен для понимания. Более того, любой, интересующийся предметом действительно глубоко, вполне в состоянии купить себе книгу Линга. Поэтому в двух пунктах мы оставили лишь сведения, представляющие собой практический интерес, полностью опустив академическую часть.
4.1 Распределение веществ между клеткой и средой
Сначала вспомним некоторые факты. При 0 °С и в отсутствие инсулина большая часть D-глюкозы и глицина находится в воде мышечного волокна, то есть не связана клеточными структурами (этим отличаются еще 20 неэлектролитов). Добавление инсулина вместе с праймером при 25 °С создает в мышечных волокнах лягушки центры избирательной адсорбции D-глюкозы (и глицина).
Добавление в безглюкозную среду лактозы стимулирует Е. coli синтезировать три белка, один из которых сразу стал рассматриваться в качестве лактозного насоса (в соответствии с действующей в научных кругах фантастической парадигмой), названного лактозной пермеазой. Однако острый конфликт концепции насосов с законом сохранения энергии заставляет пересмотреть функцию этого белка. Альтернатива состоит в том, что он является инсулиноподобным внутриклеточным гормоном. Это интересное предположение основывается на сходстве действия этой пермеазы в отношении накопления лактозы в Е. coli с действием инсулина на накопление D-глюкозы в мышце лягушки. И второе: пермеаза обнаруживается не в мембранной фракции гомогената Е. coli, а только в цитоплазматической.
[Академическая часть]
4.2 Проницаемость
В ТАИ поверхность клетки, условно называемая клеточной мембраной, является пограничным состоянием все той же системы фиксированных зарядов и связанной воды, характерной для всего тела клетки (непринципиальные изменения вносятся лишь процессами, характерными для межфазной границы).
[Академическая часть]
Модель строения клеточной мембраны в соответствии с ТАИ отличается высочайшей гибкостью благодаря заложенным в нее физическим принципам. Согласно этой модели, проницаемость клетки определяется сорбционными свойствами поверхности клетки, ее более глубоких слоев и всей протоплазмы в целом. Кроме того, важную роль в этих процессах играет и связанная внутриклеточная вода. Все эти факторы проницаемости могут широко варьировать от одного типа клеток к другому — в зависимости от потребностей клетки в ионах, неэлектролитах и амфолитах — например, в свободных аминокислотах и даже в гигантских молекулах белков. Никаких трудностей в объяснении столь значительных различий между клетками ТАИ не испытывает.
4.3 Регуляция объема клетки
Объем клетки складывается в основном из объема воды и клеточных белков. Соотношение количества воды и белков не остается постоянным и зависит как от физиологического состояния клетки, так и от ее типа. В целом это соотношение определяется тремя факторами, каждый из которых сводится, в конечном счете, к различиям в свойствах белков и в их количестве.
Первым фактором является способность доступных для растворителя участков полипептидных цепей и целых белков с полностью развернутой конформацией связывать воду, организуя ее в многослойную структуру поляризованных, ориентированных в пространстве молекул воды. Равновесный объем клетки определяется
- балансом сил между адсорбцией воды, увеличивающей объем клетки, и
- двумя другими факторами, противодействующими увеличению объема:
- солевыми связями (внутри- и межбелковыми), возникающими между фиксированными зарядами повсюду в клетке и ограничивающими способность белков связывать воду, и
- веществами с низким коэффициентом распределения между клеткой и средой (величиной q).
В клетке эти вещества представлены только свободной фракцией и, поскольку их концентрация в клеточной воде меньше, чем в среде, этот компонент в общем балансе осмотических сил способствует потере воды клеткой, то есть уменьшению ее объема — вода уходит туда, где концентрация растворенных веществ выше.
Реальность первого из упомянутых факторов контроля объема клетки (т.е. адсорбции воды полипептидной цепью) подтверждается тем, что
- выделенные мышечные волокна лягушки сохраняют свой нормальный объем не только в физиологическом растворе, но и во влажном воздухе с таким же парциальным давлением пара, что и у раствора Рингера
- состояние 95% воды в мышечном волокне лягушки подчиняется изотерме адсорбции Брэдли
- лишь полноразвернутые или экстравертные модели, такие, как желатин, ПЭО и ПВМЭ, способны поглощать столько же воды, сколько и клетки.
Роль солевых связей между фиксированными зарядами подтверждается тем, что интактные клетки сильно набухают в изотоническом растворе КСl (разрушающем солевые связи), но не меняют своего объема в изотоническом растворе NaCl, не способном разорвать солевые связи в клетке в состоянии покоя из-за низкого сродства карбоксильных групп к Na+. Вклад веществ, представленных в клетке только одной, свободной фракцией, растворенной в клеточной воде (и имеющих низкий коэффициент распределения), подтверждается тем, что клетки сжимаются в присутствии в среде NaCl в высоких концентрациях (величина q для Na+ невелика) и, с другой стороны, набухают в изотонических растворах веществ с величиной q, близкой к 1, таких как мочевина и этиленгликоль.
Общий механизм набухания клетки при повреждении и под влиянием КСl (в повышенных концентрациях), а также зависимость этого набухания от концентрации NaCl в среде и от содержания АТФ в клетке говорит в пользу взглядов ТАИ на регуляцию клеточного объема и ключевую роль АТФ как электрон-акцепторного кардинального адсорбата (ЭАКА) в поддержании состояния покоя живой клетки.
4.4 Потенциал покоя
На протяжении вот уже более 100 лет, со времени публикации мембранной теории потенциала покоя Бернштейна, предпринималось немало попыток найти искусственную (модельную) систему, свойства которой полностью отвечали бы требованиям мембранной теории потенциалов. Все они были безуспешны.
Причина неудач — в ошибочности самой теории. На реальной мембране, какой она предстает перед нами в виде липидной пленки любой толщины, не может возникнуть мембранный потенциал так, как это представляет себе мембранная теория. Действительно, как только проникающие в клетку ионы войдут в мембрану, их сразу остановит притяжение оставшихся снаружи ионов с противоположным зарядом, для которых мембрана непроницаема. В результате на границе раздела образуется двойной электрический слой, создающий устойчивую разность потенциалов, но не между сторонами мембраны, а на одной или на обеих границах раздела фаз — липидная фаза/внешняя среда, липидная фаза/внутренняя среда, на что указывала еще теория Нернста.
Всякий раз, когда приверженцы мембранной теории отвергали ту или иную разумную модель как мешающую им жить, оказывалось, что она идеально соответствует теории локализованной поверхностной адсорбции (ЛПА). Две такие модели особенно интересны:
- стеклянная мембрана (особенно в свете открытия Горовитцем роли поверхностных катионов в образовании электрического потенциала) и
- коллодиевая мембрана (особенно в свете открытия Соллнером с сотр. роли фиксированных поверхностных карбоксильных групп в образовании электрического потенциала).
Однако лучшей из всех искусственных моделей стала их комбинация — стеклянный электрод, покрытый окисленным коллодием (КС-электрод), и его модификация — стеклянный электрод, покрытый коллодием и обработанный затем полилизином (ПКС-электрод).
И КС-, и ПКС-электроды доказывают, что возникающий на них потенциал не имеет ничего общего с проницаемостью мембран для ионов — величину и знак потенциала определяют поверхностные фиксированные анионные центры. Поражает чрезвычайная схожесть КС-модели с живой клеткой:
- и потенциал покоя мышцы лягушки, и потенциал КС-электрода нечувствительны к Сl-
- и потенциал покоя мышцы лягушки, и потенциал КС-электрода нечувствительны к двухвалентным катионам, таким, как Mg2+
- сравнительная чувствительность к ионам щелочных металлов как потенциала покоя мышцы лягушки, так и потенциала КС-электрода соответствует относительно низкой величине с (низкой плотности электронов на фиксированных анионах)
- и потенциал покоя мышцы лягушки, и потенциал КС-электрода примерно в 100 раз более чувствительны к Н+, чем к К+.
На данный момент все или почти все корректно измеренные потенциалы покоя того или иного вида клеток можно с высокой точностью количественно описать, по сути, одним и тем же уравнением Линга, которое является производным более общего уравнения распределения веществ между клеткой и средой, учитывающего кооперативное взаимодействие центров связывания.

|